利用冷冻起始材料从一开始就建立细胞疗法开发的稳定性
多年来,细胞治疗项目一直使用新鲜的白细胞提取物作为起始材料。当时的假设是,如果能最大限度地缩短从采集到制造的时间,就能最大限度地提高存活率。因此,新鲜白细胞分离不仅成为一种科学偏好,而且成为一种操作传统,影响着临床团队如何安排供体、生产车间如何分配产能以及项目如何安排日常执行。项目负责人将任何偏离 “新鲜 “的行为都视为一种需要证明其合理性的风险,而不是一种需要评估的选择。但现实总是在阻碍我们。
随着该领域的成熟,以及围绕可重复性、规模和满足不断变化的监管期望的压力不断增加,这种传统模式的局限性日益明显。新鲜材料虽然在概念上很有吸引力,但在项目寻求更大控制力的同时,也带来了巨大的操作和科学变数。越来越多的 “新鲜 “不再是 “更好 “的默认定义。团队正在感受到新鲜材料是多么脆弱。一次延误就可能导致整个生产计划的失败,当紧张的加工窗口被歪曲时,捐赠者之间的可变性会如何下滑,当起点不断变化时,真正比较批次的差异会变得多么困难。处理新鲜材料所需的时间敏感性和协调性带来了不可预测性,直接影响到存活率、变异性和其他关键参数,而随着计划的进展,这些问题只会越来越多。
冷冻起始材料已成为这些令人头痛问题的反面教材。它是一致的。可预测。它使采集与生产脱钩,增加了灵活性,清除了路障。当通过与 GMP 一致的自动封闭流程 (ACP) 实现新鲜白细胞的冷冻保存,并将其整合到完整的端到端供应链平台中时,就能降低风险,提高可预测性,为早期阶段的项目开辟一条更具可扩展性的道路。
新鲜白细胞分离的结构限制
当然,与新鲜启动材料相关的挑战造成了调度的复杂性和后勤上的不便。但除了这些结构上的障碍外,使用新鲜白细胞分离材料的局限性是生物系统固有的,也是实际操作所造成的限制。
新鲜材料从采集完成的那一刻起就开始发生变化。即使在严格的过程控制下,采集细胞的活力、表型和功能属性也会受到各种变量的影响。处理不一致、操作员技术或采集试剂盒的差异、运输持续时间、预处理等待时间……各种因素的数量之多使得一致性难以实现,尤其是在利用活细胞制造细胞疗法所需的紧迫时间内。出于必要,新鲜的工作流程将整个链条(采集、包装、运输、接收和第一个制造步骤)压缩到一个狭窄的窗口,需要在理想的 24 至 48 小时内完成。这就迫使团队必须遵守严格的时间表,任何干扰,从天气延误到现场人员限制,都可能影响材料的完整性或需要重新安排时间。正因为如此,团队通常会为 “新的一天 “做准备,过度投入人员和资源,这并不是因为生物学要求这样做,而是因为工作流程的脆弱性要求这样做。
这些压力会影响操作以及分析解释和监管文件。当起始材料的可变性大于工艺本身的可变性时,就很难分离和评估真正的工艺性能。例如,细胞活力的漂移可能被误解为工艺变异性。监管审查人员在寻求不同运行或阶段的可比性时,可能会遇到将差异归因于环境而非受控变量的叙述。在这些关键点上,新鲜材料可能会带来科学噪音,而在这些关键点上,清晰度是至关重要的。
通过低温保存稳定输入变异性
如果以受控、经过验证、符合 GMP 标准的方式对白细胞抽取的起始材料进行冷冻保存,就能提供一条截然不同的途径。ACP 支持的冷冻保存不是与时间赛跑,而是将细胞状态停滞在一个确定的特征点上,最好是在采集后 24 至 48 小时内。这就建立了一个稳定的基线,在此基础上可重复、可预测地进行生产。
通过自动化处理、受控速率冷冻和与 GMP 一致的工作流程,冷冻保存能以标准化和可重现的方式保持细胞活力和功能。产出的不是折衷方案,而是稳定一致的材料,可以进入生产和下游处理过程,而不会出现新鲜材料的物流变化。早期阶段的团队可从始终如一的制备输入中获得信心,从而获得更清晰的分析解释和更可行的见解。
在操作上,低温保存的起始材料使计划摆脱了捐献者协调安排的限制。生产运行可在套系准备就绪、人员可用时进行规划。采集与制造的脱钩提高了效率,减少了停机时间,有助于减轻新鲜工作流程中经常出现的一连串延误。在不牺牲科学有效性的前提下,计划获得了灵活性。事实上,通过减少新鲜材料固有的批次间变异性,他们还能获得更高的精确度。
因此,对起始材料进行低温保存既是一种实用选择,也是一种战略选择,它支持从临床前工作到第一阶段再到第二阶段的可控、迭代式工艺开发途径,减少了中断性过渡,并从一开始就将可扩展性纳入 SOP。
一体化将冷冻保存视为一个系统,而不是一个步骤
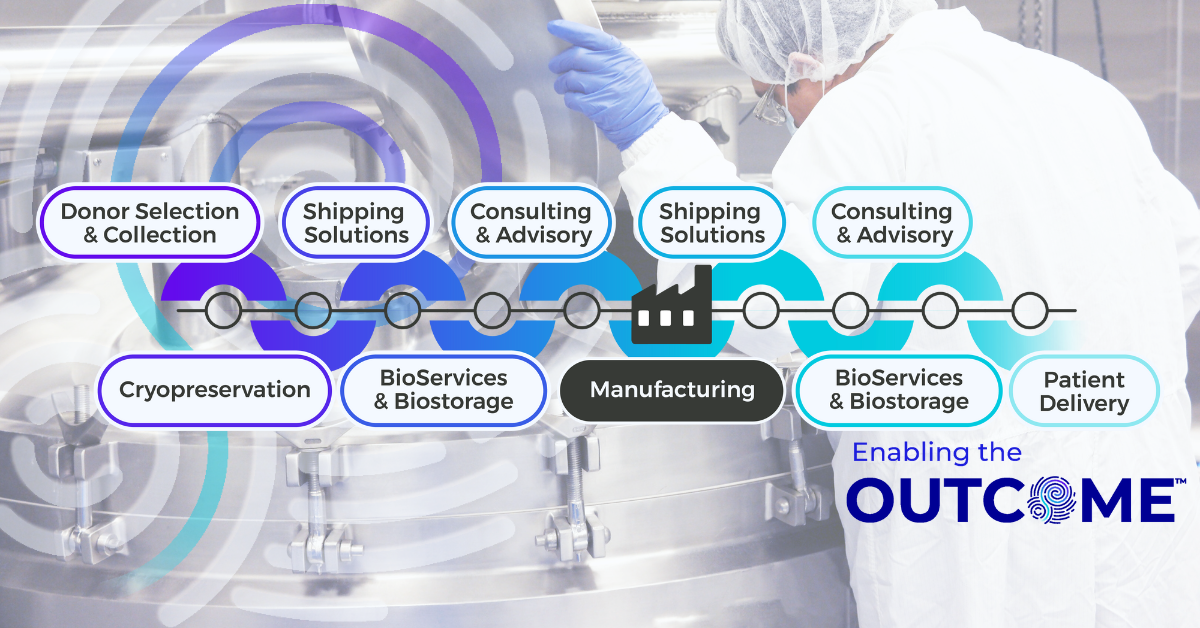
虽然冷冻保存本身至关重要,但其作为一种方法的可靠性取决于周围的基础设施。冷冻可在任何地点实施,从采集点到第三方处理器,再到生产基地。冷冻的方式能否支持监管合规性、全球分销、长期可扩展性计划以及可控一致性的标准化?这在本质上是不同的。这就是 Cryoport 系统公司供应链管理综合平台方法的关键所在,它将IntegriCell®低温保存、BioServices 和生物储存、定制运输系统、物流和持续监控整合在一个单一供应商模式中。
冷冻保存不能脱离其上游和下游环境。运输系统和二次包装会影响温度曲线。运输路线影响暴露风险。储存环境决定稳定性。各环节的数据连续性决定了如何解释偏差。将这些步骤分割给多个供应商会带来变数,更有可能出现无法追踪的偏差。
Cryoport Systems 的集成基础设施通过横跨全球的统一流程消除了许多此类漏洞。在我们的全套生物服务中,采集、制造和管理试剂盒都是标准化的。ACP 低温保存在与 GMP 一致的流程下执行,这些流程与生物储存协议、针对低温特性设计的运输系统以及由持续监控和审计就绪的 Chain ofCompliance®文件支持的全球配送通道无缝集成。身份链、监管链和条件链在单一框架内得到维护。可定制的咨询和顾问服务提供运输风险评估和运输通道资格认证,为您的监管申报提供支持。工作流程的各个环节都有文件记录,并可一并控制。
对于申办者来说,这既降低了运营风险,也减轻了监管负担。项目无需协调多个文件系统,也无需解释供应商解决方案之间的差异。取而代之的是,申办者可以提出一个具有凝聚力且向前兼容的控制策略,从材料进入低温保存流程到最终生产和患者用药,都能显示出稳定性。
为监管审查和投资者评估提供更有力的支持
越来越多的监管机构和投资者在评估早期项目时,不仅看其科学价值,还看其运营成熟度和风险缓解程度,以此来衡量项目是否已准备好扩大规模。起始材料的低温保存(加上符合 GMP 标准的生物储存和物流)可全面加强项目的地位。
从监管角度看,输入材料的一致性可简化可比性评估,支持更清晰的批次分析,并减少效价和特性化验中无法解释或意想不到的差异。如果起始原料稳定且记录详实,审核人员就可以把重点放在工艺性能上,而不必试图将工艺影响与输入变异性区分开来。
从投资者的角度来看,综合低温保存战略意味着长远的考虑。它表明,该计划已将其早期阶段的做法与未来多站点、多地域扩展的需求相结合。它表明,通常会导致里程碑延迟或烧钱增加的运营风险已得到积极缓解。在资本效率比以往任何时候都受到更严格审查的情况下,展示可预测运营路径的能力就显得尤为重要。
使用低温保存、控制良好的起始材料,使开发说明与这两个群体的期望相一致。因此,该计划不仅在科学上令人信服,在操作上也非常稳健,为进入后期阶段的下一步工作做好了准备。
可预测的发展路径为未来规模奠定基础
从一开始就采用低温保存工作流程的计划,其开发进展方式会发生转变。日常操作变得更加可靠,批次间数据的可解释性也更强。生产部门可以积极主动地规划套间利用率,而不是在最后一刻不断调整采集计划。临床团队可以将采集管理与生产分开,工作流程变得可预测和简化。
最重要的是,该计划在通过每个阶段时都减少了强制过渡。同样的低温保存策略可以稳定早期阶段的材料,支持第二阶段和第三阶段的扩展,而无需进行重大的系统调整。随着数量的增加和地域的扩大,文件和一致性保持稳定。这种连续性降低了风险,同时加快了时间进度,最终为商业化开辟了一条更顺畅的道路。
新鲜的起始材料虽然一直被认为是标准,但它带来了操作上的脆弱性和科学上的多变性,可能会阻碍早期阶段的计划,并使长期发展复杂化。冷冻起始材料,如果在一个综合的端到端供应链中,根据一个 ACP 执行,则提供了一个更加稳定和可扩展的替代方案。
Cryoport Systems 的 IntegriCell 低温保存技术使申办者能够从第一天起就采用这种模式,使项目在整个临床阶段和商业化过程中具有更高的可预测性和更强的监管协调性。申办者不再依赖于被动的协调,而是将其发展战略建立在一个旨在实现一致性和成长性的平台上。
这一领域正在从传统的新鲜冷冻向设计冷冻转变。借助 IntegriCell 低温保存服务,Cryoport Systems 提供了所需的基础设施和操作集成,使这种转变不仅可行,而且具有战略优势。